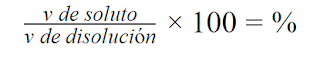con un nuevo instrumento.
Marco teórico
Para la misma masa de gas, si la temperatura es invariable, es decir, es constante. El volumen aumenta al disminuir la presión y viceversa, por lo que, podemos observar que el volumen y la presión son inversamente proporcionales.
Como dato extra, el nombre de la Ley se origina con el científico inglés Robert Boyle (1627-1691) y el francés Edme Mariotte (1620-1684) que llegaron a la misma conclusión con sus experimentos.
Con respecto a los gases según la teoría cinética de la materia, las partículas de los gases están más separadas y se encuentran unidas por fuerzas muy débiles, por lo que su atracción es mínima.
El gas ocupa todo el recipiente del que dispone, expandiéndose y comprimiéndose. Además cuando dichas partículas se mueven, se produce un choque entre ellas y las paredes del recipiente en donde se encuentre, producen presión.
Materiales
Procedimiento
Antes que nada, debemos juntar todo las piezas del sensor de presión. Primero conectamos el sensor de presión al airlink (emisor de Bluetooth). Posteriormente unimos el tubo conector junto con la jeringuilla a lo que juntamos anteriormente.
Previamente deberíamos haber instalado la aplicación SPARKvue en nuestro dispositivo para poder llevara a cabo la práctica.
A continuación, vamos a enlazar el dispositivo con el Airlink a través de la app, gracias al Bluetooth.
Después de tener todo en orden, es decir, una vez que hemos creado una gráfica debemos poner a correr el cronómetro.
Apretamos la jeringuilla hasta el volumen deseado y escogemos una de las opciones de la aplicación para poder ver la presión sometida.
Hay que tener en cuenta que esta unidad está en P(KPa). Llegados a este punto podremos observar como la gráfica empieza a subir o a bajar, depende de la presión ejercida en la jeringuilla.
Por último apuntamos los datos en cada medición.
Cálculos
Presión (KPa)
|
Volumen (ml)
|
92.1
|
20
|
190.1
|
12
|
220.4
|
10
|
295.6
|
7
|
397.5
|
5
|
437
|
4
|
589.6
|
3
|
Conclusiones
Con este ejercicio he podido poner en práctica la Ley de Boyle-Mariotte, ya que, anteriormente solo había realizado ejercicios en el cuaderno.
He aprendido a utilizar una nueva herramienta, SPARKvue y a su vez he ido sabiendo un poco más sobre ella en general. También me llevo el hecho de haber usado un sensor de presión por primera vez y me ha parecido muy divertida la experiencia, ya que, la jeringuilla está bastante fuerte y dependiendo de hasta donde quieres bajar empieza a costar cada vez más.
He podido observar de antemano como el volumen y la presión son inversamente proporcionales, se puede observar perfectamente en los datos tomados y he podido aprender a interpretar gráficas como la enseñada anteriormente